Biologi Laut: Air, Asal Mula dan Sifatnya.
Air adalah benda ajaib yang sangat penting bagi kehidupan di bumi. Tanpa air, bumi tidak akan menjadi planet ramah seperti yang kita kenal. Kita telah membahas di tulisan sebelumnya bahwa sebagian besar permukaan bumi kita tertutup oleh air. Namun pernahkah terpikirkan dari manakah asal air yang ada di bumi ini?
Sebagian teori menyebutkan bahwa air berasal dari gas (H20), CO2) yang keluar dari dalam bumi melalui gunung berapi di masa bumi purba. Namun ada sebagian teori yang menyatakan bahwa air berasal dari komet yang menghantam bumi. Terlepas dari teori mana yang lebih tepat, ternyata air diperkirakan memang berasal dari dalam bumi itu sendiri atau jangan-jangan air merupakan benda asing atau alien karena berasal dari luar angkasa. Untuk memahami keajaiban air, kita akan mulai dari hal paling dasar tentang air.
Air merupakan materi, dan setiap materi tersusun atas unsur. Setiap unsur terdiri dari atom. Untuk memahami tentang atom, unsur, molekul, energi silakan perlahan membacanya disini
Molekul Air
Molekul air terdiri dari tiga atom. Dua atom hidrogen dan satu atom oksigen. Daerah dua hidrogen bermuatan positif sedangkan daerah oksigen bermuatan negatif. Ada dua jenis ikatan kimia yang bekerja di molekul air. yaitu ikatan kovalen dan ikatan hidrogen. Ikatan kovalen bekerja mengikat antara dua atom hidrogen dengan satu atom oksigen. Ini merupakan ikatan yang umum terjadi di setiap molekul organik. Sedangkan ikatan hidrogen bekerja menghubungkan satu molekul air dengan molekul air lain. Penjelasan tentang ikatan kimia bisa dibaca disini. Ikatan hidrogen inilah yang membuat air begitu unik.
 |
| Ikatan kovalen antar satu oksigen dan dua hidrogen. Ikatan hidrogen antara molekul air. |
Apa saja sifat ajaib air yang disebabkan oleh ikatan hidrogen? mari kita bahas satu persatu.
Kohesi
Pernah melihat serangga air yang berjalan di permukaan air? Serangga dapat berjalan diatas air karena ada tegangan permukaan yang diberikan oleh molekul air. Sesama molekul air dilekatkan oleh ikatan hidrogen sehingga air menyatu satu sama lain dan memberikan tegangan pada permukaan air sehingga sulit untuk ditembus oleh kaki serangga. Kemampuan menempel antar sesama molekul ini lah yang disebut dengan kohesi.
 |
| Serangga air (Water Strider) mampu berjalan diatas air dengan memanfaatkan tegangan permukaan molekul air. |
Respon Terhadap Panas
Hal pertama yaitu apa yang disebut dengan Panas Penguapan. Panas penguapan merupakan sejumlah energi panas yang dibutuhkan untuk menguapkan sejumlah unit massa dari materi pada suhu konstan. Panas yang dibutuhkan untuk menguapkan air sangatlah tinggi dikarenakan adanya ikatan hidrogen. Ini berarti air menguap dengan perlahan dan menyerap energi panas yang relatif tinggi (1000C)
Berikutnya adalah Panas Laten Fusi. Ini adalah sejumlah panas yang diserap per unit massa untuk berubah bentuk dari cair ke gas (1000C), atau kehilangan panas dan berubah dari cair ke padat (00C). Panas laten untuk air sangat lah tinggi dikarenakan oleh ikatan hidrogen. Mencairkan es membutuhkan banyak panas, sedangkan membuat es melepas banyak panas.
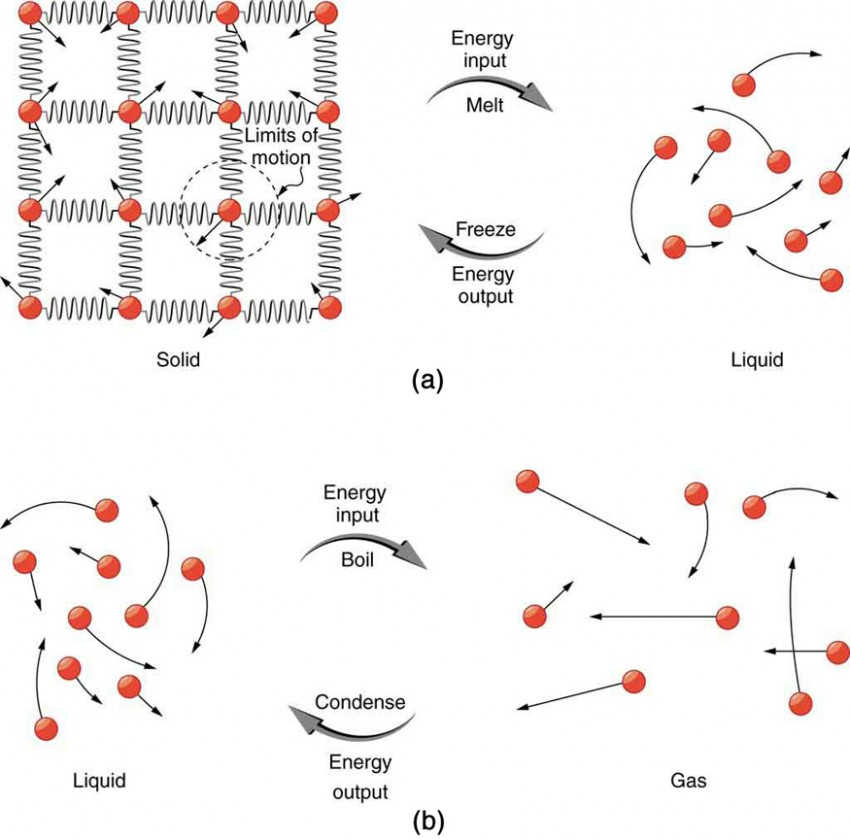 |
| Gerak molekul saat kehilangan atau menyerap panas. |
Efek ketiga adalah Kapasitas Panas. Kapasitas panas adalah sejumlah energi yang dibutuhkan untuk menaikkan suhu satu derajat celcius pada setiap satu gram materi.
 |
| Tabel Heat Capacity |
Perhatikan tabel diatas. Aseton memiliki nilai 0,51, aluminium 0,22, dan amonia 1,13. Sedangkan air memiliki nilai yang sempurna yaitu 1. Ini berarti air adalah penyangga yang sempurna bagi kenaikan atau penurunan suhu sehingga fluktuasi suhu di air lebih rendah dibanding udara. Kemampuan ini menyebabkan air mampu memoderasi iklim di bumi dengan baik dan menjadi termoregulator bagi planet ini.
Bentuk Fase Air
Air berwujud tiga fase yaitu gas, cair, dan padat. Pada umumnya cairan mengalami peningkatan kerapatan ketika pada suhu rendah. Semakin turun suhu maka kerapatan cairan akan semakin tinggi. Hal ini tidak berlaku pada air. Kerapatan air memang akan terus meningkat ketika suhu turun namun peningkatan kerapatan ini akan mencapai titik maksimal pada suhu 40C. Ketika suhu terus turun maka keanehan mulai terjadi. Ikatan hidrogen pada molekul air justru membentuk formasi heksagonal.
 |
| Formasi Heksagonal Pada Es |
Formasi heksagonal akan menyebabkan lebih sedikit molekul yang bisa mengisi volume tertentu. air akan memadat menjadi es dengan struktur kimia yang lebih renggang. Lalu apa konsekuensinya? konsekuensinya adalah es mengapung! Apa pentingnya es mengapung? Bayangkan jika es tenggelam saat terbentuk di musim dingin. Es akan terus terbentuk dan dengan segera memenuhi dasar perairan dan membunuh semua organisme perairan saat musim dingin.
 |
| Ketika suhu atmosfir mencapai 0 derajat celcius maka permukaan air akan membeku, namun bagian bawah air akan tetap menjaga suhu di 4 derajat agar tidak membeku dan tetap bisa dihuni organisme. |
Kerapatan air juga mendorong sirkulasi air laut. Air yang lebih hangat dengan kerapatan yang rendah berada di permukaan. Ketika air menjadi lebih dingin maka kerapatannya akan meningkat dan membawa mereka turun ke bawah. Hal ini memungkinkan pertukaran air dengan segala komponen di dalamnya.
Kekuatan Melarutkan
Air adalah pelarut universal. Pelarut (Solvent) adalah cairan yang melarutkan padatan, cairan atau gas menghasilkan larutan (Solution). Zat-zat yang dilarutkan disebut zat terlarut (solute). Di bagian awal kita sudah berbicara tentang muatan positif dan negatif pada molekul air. Perbedaan muatan pada molekul air ini akan tarik menarik dengan zat lain yang juga bermuatan.
Kita ambil contoh garam dapur atau NaCl. Pada tulisan sebelumnya tentang ikatan ionik (baca disini) Na dan Cl akan membentuk ion Na+ dan Cl-. Ketika NaCl dilarutkan dalam air maka ion positif natrium akan tarik menarik dengan oksigen yang negatif dari molekul air. Sedangkan ion negatif Cl akan tarik menarik dengan hidrogen yang positif dari molekul air.
Air di planet kita mengandung banyak sekali garam sebagai zat terlarut. Jumlah total garam padat yang terlarut isebut dengan salinitas. Pada rata-rata air laut teraapat sekitar 3.5% garam. Biasanya ditulis 350/00 (part per thousand, ppt) ini berarti dalam 1000 gram air laut terdapat 35gram garam. Satuan lain yang digunakan adalah PSU atau Practical Salinity Units. Salinitas suatu perairan bsia bervariasi bergantung pada tingkat penguapan, curah hujan, dan aliran sungai.
Hubungan dan jumlah rasio antara ion-ion di laut selalu konstan. Meskipun kita pergi ke daerah berbeda kita mungkin akan menemui salinitas yang beragam, namun dengan rasio ion yang tetap. Konsistensi inilah yang dapat kita manfaatkan untuk mengetahui jumlah ion-ion tersebut dengan mangukur salah satunya, biasanya ion Cl.
Pengukuran paling umum biasanya menggunkan alat refraktometer dengan teknik refraksi optik. Semakin banyak garam maka cahaya akan semakin terefraksi. Cara lain yaitu dengan mengukur konduktivitas ion. Semakin banyak ion maka akan semakin tinggi nilai konduktivitasnya. Kita juga mengukur salinitas dengan teknik Kloriniti. Kita menghitung jumlah clorin per 1000 ml air laut. Nilai salinitas bisa kita dapatkan dengan cara mengalikan nilai kloriniti dengan 1.81.
Apa Yang Terjadi Pada Gas Terlarut Ketika Suhu Laut Berubah?
Gas pertama yang akan kita bahas adalah oksigen. Umumnya kelarutan gas akan meningkat ketika suhu air turun. Pola ini menyebabkan akan tersedia banyak oksigen dalam air yang lebih dingin. Seperti yang kita ketahui bahwa terdapat 21% oksigen di atmosfir sedangkan di air kadar oksigen terlarut berkisar antara 0,4%-0,8%. Oksigen tidak tersebar secara merata di air tergantung dengan kedalaman.
Dari gambar 1 kita melihat pola yang unik dari distribusi oksigen pada air laut. Mengapa terdapat peningkatan kadar oksigen di permukaan lalu penurunan kadar oksigen pada kedalaman 500-1000 meter. Namun pada kedalaman setelah 1000 meter terjadi peningkatan kadar oksigen kembali?
Perhatikan gambar 2, permukaan air laut adalah tempat dimana terjadi fotosintesis yang mengahasilkan oksigen. Selain itu di area ini terjadi pencampuran antara atmostif dan air. Namun ketika memasuki kedalam 500 meter hingga ke 1000 meter, respirasi biologis terjadi tanpa adanya fotosintesis dan pencampuran udara dari atmosfir sehingga konsumsi oksigen meningkat tanpa adanya suplai oksigen yang baru. leh sebab itu daerah ini disebut zona oksigen minimal. Pada kedalaman lebih dari 1000 meter kerapatan air meningkat dan suhu semakin turun. Suhu yang semakin turun meningkatkan kelarutan oksigen pada air. Lalu bagaimana dengan gas karbondioksida?
Karbondioksida dihasilkan dari respirasi organisme, semburan gas vulkanik, atau gas buang dari industri. Kadar karbondioksida di atmosfir berkisar antara 0,04%-0.06%. Bagaimana kadar karbondioksida di air? Sekitar 80% gas terlarut di lautan adalah karbondioksida. Mengapa kadar karbondioksida penting untuk diperhatikan?
Karbondioksida (CO2) bereaksi dengan molekul air (H2O) membentuk asam karbonat (H2CO3). Asam karbonat akan menurunkan pH air laut. Air laut memiliki pH normal sekitar 8. Dengan melimpahnya H2CO3 maka pH air laut akan turun dan menjadi lebih asam. Proses ini disebut acidification atau pengasaman air laut. Lalu apa pengaruhnya?
Sebagian besar organisme laut membentuk cangkang atau struktur eksoskeleton yang terbuat dari kalsium karbonat (CaCO3). Kalsium karbonat juga merupakan bahan utama pembangun terumbu pada ekosistem terumbu karang. Pada kondisi air laut yang terlalu asam, kalsium karbonat dapat larut dengan sangat mudah. Jika ini terjadi terus menerus maka cangkang atau struktur eksternal hewan laut akan sulit sekali terbentuk dan terumbu karang semakin sulit untuk mendeposit kalsium karbonat pada terumbu. Kita akan membahas ini lebih dalam pada pembahasan berikutnya.












Comments
Post a Comment