Kimia Kehidupan: Dari Atom Hingga Bagaimana Keputusan Manusia Dibuat!
Setiap organisme tersusun atas materi. Materi adalah segala sesuatu yang menempati ruang dan memiliki massa dan tersusun atas unsur. Unsur tersusun atas bahan yang tidak bisa di pecah lagi melalui reaksi kimia biasa yang disebut dengan atom. Setiap unsur dapat kita temukan di tabel periodik unsur. Ini adalah bagian terpeting sebagai pondasi mempelajari biologi. Silakan pelajari perlahan dan jangan sungkan untuk didiskusikan.
Dalam tabel periodik kita akan menemukan setiap kotak berisi satu unsur. Setiap unsur memiliki nomor atom. Nomor atom adalah jumlah proton yang dimiliki oleh sebuah unsur. Unsur yang tersusun dalam tabel periodik dibaca dari kiri atas ke kanan kemudian turun ke kiri di baris kedua dan seterusnya. Dasar penyusunan ini berdasarkan jumlah nomor atom.
Sebagai contoh, unsur hidrogen berlambang H berada di posisi
paling kiri atas karena hidrogen memiliki satu proton. Kemudian diikuti oleh
unsur helium berlambang He yang memiliki dua proton lalu litium berlambang Li
yang memiliki tiga proton dan seterusnya.
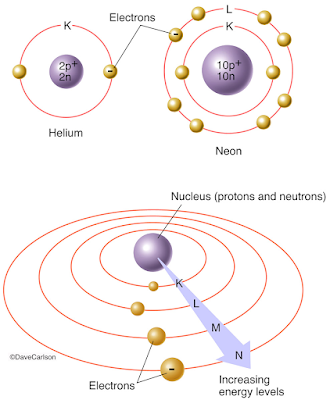
Setiap unsur memiliki atom yang unik dan menentukan sifat suatu unsur. Setiap atom tersusun atas tiga sub partikel; proton yang bermuatan positif, neutron tidak bermuatan atau netral, dan elektron yang bermuatan negatif. Proton akan melekat dengan neutron dan menyusun inti atom sedangkan elektron mengitari inti atom dalam bentuk orbital.
Jumlah proton dalam setiap unsur selalu tetap oleh
sebab itu berubahnya jumlah proton akan menyebabkan unsur berubah. Unsur emas berlambang
Au (Aurum) memiliki jumlah proton 79. Jika atom emas mengalami penambahan satu
proton maka emas akan menjadi air raksa atau Hg (Hidrogirum). Para alkemis
zaman dahulu berusaha menemukan cara memanipulasi jumlah proton suatu unsur
agar unsur apapun dapat dimanipulasi menjadi emas.
 |
| Ilustrasi atom hidrogen, helium, dan litium.(astronomy.nmsu.edu) |
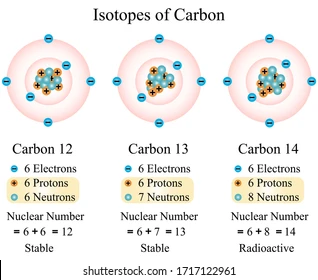
Atom memiliki massa. Massa atom dihitung dengan menambah jumlah proton dan neutron. Mengapa elektron tidak termasuk dalam total massa? Karena elektron hampir tidak memiliki massa sehingga massa elektron dianggap diabaikan. Atom karbon berlambang C memiliki jumlah proton enam maka disebut bernomor atom 6. Karbon juga memiliki neutron enam. Artinya jumlah massa atom karbon berarti 12. Akan tetapi tidak seperti jumlah proton yang tetap, jumlah neutron dapat berubah.
Jika sebuah atom memiliki jumlah neutron yang berbeda dengan
jumlah protonnya maka atom tersebut disebut dengan isotop. Jika karbon memiliki neutron 7 maka nomor massanya menjadi
13 dan disebut karbon isotop 13 (C-13). Begitupun jika neutronnya berjumlah 8
maka akan menjadi karbon 14 atau C-14 (Karbon radioaktif).
Selanjutnya kita akan berfokus pada elektron karena elektron lah yang menentukan seluruh reaksi dan ikatan kimia pada makhluk hidup. Elektron seperti yang telah disampaikan sebelumnya berada di sekitar inti atom. Mereka berputar mengitari inti atom menyerupai planet yang melintasi tata surya (meskipun analogi tersebut tidak terlalu tepat).
Setiap elektron melaju di
lintasan yang bertingkat-tingkat. Bayangkan dihitung dari matahari, planet
merkurius berada di lintasan tingkat pertama diikuti venus yang berada di
lintasan kedua dan seterusnya. Setiap level tingkatan memiliki energi yang berbeda.
Semakin tinggi tingkat lintasan, maka energi elektron tersebut semakin besar.
Sebelum membahas tingkat energi elektron lebih jauh, kita harus kembali sejenak
untuk mengingat apa itu energi.
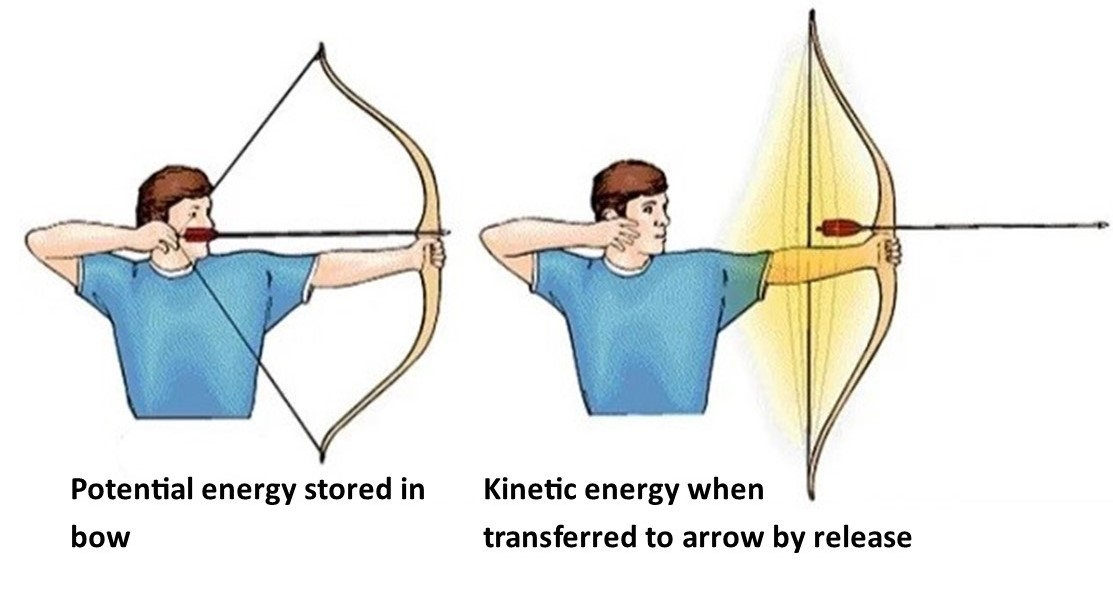
Energi adalah sejumlah kapasitas untuk menyebabkan perubahan atau kapasitas untuk melakukan kerja. Terdapat dua jenis energi yaitu energi potensial dan energi kinetik. Energi potensial adalah energi yang dimiliki oleh sebuah materi dikarenakan lokasi atau strukturnya. Contoh, sebuah benda yang berada di ketinggian bangunan memiliki energi potensial lebih besar dibanding benda yang berada di lantai gedung. Contoh lain adalah anak panah yang berada dalam posisi ditarik memiliki energi potensial yang lebih besar dibanding anak panah yang berada dalam kondisi tidak ditarik. Ketika anak panah dilepaskan dari busurnya maka anak panah akan melesat dan mengubah energi potensial menjadi energi kinetik.
Kemudian tipe energi potensial kedua
yaitu energi yang diakibatkan karena strukturnya. Struktur kimia lemak
menyimpan energi potensial yang lebih besar (9 kalori per gram) daripada karbohidrat
atau protein (keduanya 4 kalori per gram). Saat organisme makan, sebenarnya
mereka memecah struktur kimia yang menyimpan energi potensial tersebut lalu
diubah ke bentuk kimia lain berupa ATP yang juga menyimpan energi potensial
dalam ikatan fospat agar dapat digunakan untuk melakukan metabolisme.
Kembali ke elektron, energi yang tersimpan pada elektron akan
meningkat jika mereka berpindah ke lintasan atau kulit atom yang semakin
menjauhi inti atom dan akan kehilangan energi
potensial ketika mereka turun ke tingkat lintasan atau kulit yang
mendekati inti. Kulit terluar yang
terisi oleh elektron ini disebut valensi
dan elektron yang berada di kulit terluar disebut elektron valensi. Kita akan berfokus pada elektron valensi karena
elektron valensilah yang akan berinteraksi dengan elektron valensi dari atom
lain untuk membentuk ikatan kimia.
 |
| Atom litium |
Elektron memiliki aturan dalam menempati kulit atom.
Elektron akan berusaha untuk mencapai kestabilan dengan memenuhi bilangan oktet.
Bilangan oktet adalah kecendrungan elektron untuk mengisi tiap lapisan kulit
atom dengan jumlah yang tetap yaitu:
- Pada kulit pertama, ruang maksimal yang bisa ditempati adalah dua elektron. Jika atom hanya memiliki satu elektron seperti hirogen maka kulit pertama akan diisi satu elektron. Oleh sebab itu hidrogen dikatakan memiliki elektron valensi satu. Jika ada dua elektron seperti pada atom helium maka kulit pertama akan diisi oleh dua elektron. Maka helium dikatakan memiliki elektron valensi dua. Kondisi atom helium ini dikatakan stabil karena kulit atom pertama yang sudah terpenuhi dengan dua elektron. Hidrogen dan helium dikatakan berada pada periode satu pada tabel periodik unsur karena hanya memiliki satu kulit atom. Apa yang terjadi jika terdapat tiga elektron seperti pada atom litium maka dua elektron akan menempati kulit pertama dan satu sisa elektronnya akan menempati kulit kedua. Hidrogen dan litium memiliki kesamaan yaitu elektron terluarnya berjumlah satu atau bervalensi satu. Jumlah elektron valensi hidrogen dan litium inilah yang menempatkan mereka pada satu kolom yang sama yaitu unsur golongan I (berarti memiliki elektron valensi satu: lihat gambar). Jadi kulit pertama harus terpenuhi dengan jumlah dua elektron.
- Pada kulit kedua, jumlah elektron yang harus mengisinya agar menjadi stabil berjumlah delapan. Sebagai contoh pada atom karbon dengan nomor atom 6 (berproton 6 dan otomatis berelektron 6). Ini berarti kulit pertama atom karbon akan diisi oleh dua elektron. Lalu epat sisanya akan menempati kulit kedua. Sehingga karbon dikatakan bervalensi empat. Atom karbon dikatakan belum stabil karena dalam aturan oktet kulit kedua harus dipenuhi elektron hingga berjumlah delapan. Jadi karbon membutuhkan empat eletron tambahan untuk menjadi stabil. Keinginginan untuk memenuhi kulit atom pada valensi inilah yang menyebabkan unsur bereaksi dengan unsur lain. Bagaimana jika sebuah unsur sudah memiliki delapan atom pada kulit terluarnya? Maka atom sisanya akan mengisi kulit ketiga.
- Pada kulit ketiga aturan akan tetap sama dengan kulit kedua yaitu mengisi delapan elektron. Sebagai contoh atom natrium (Na). Natrium memiliki nomor atom 11 (11 proton dan 11 elektron). Konfigurasi elektron natrium akan memenuhi kulit pertama dengan dua elektron. Kulit kedua diisi dengan delapan elektron, dan kulit ketiga diisi dengan sisanya yaitu satu elektron (perhatikan bahwa natrium juga berada di golongan yang sama dengan hidrogen dan litium karena bervalensi satu namun berada dibaris/periode ke tiga yang berarti berkulit atom tiga).
Aturan bilangan oktet menyebabkan sebuah unsur memiliki kecendrungan untuk menjadi stabil dengan berusaha menarik elektron dari unsur lain atau bahkan rela melepas elektronnya. Bentuk interaksi antar elektron dari satu unsur dengan unsur lain inilah yang mendorong adanya ikatan kimia. Perhatikan unsur unsur yang sudah memenuhi bilangan oktet seperti helium; velensi dua (He), Neon; valensi delapan (Ne), Argon; valensi delapan (Ar), Kripton; valensi delapan (Kr), Xenon; valensi delapan (Xe), dan Radon yang juga valensi delapan (Rn). Mereka telah berada dalam keadaan stabil sehingga mereka sulit bereaksi/membentuk ikatan dengan unsur lain. Sifat inilah yang menyebabkan mereka disebut gas mulia atau Noble Gas. Kelompok gas mulia ini berada pada satu golongan/kolom yaitu golongan VIII yang berarti memiliki valensi delapan (kecuali helium).
Ikatan Kovalen
Ikatan kimia yang terbentuk karena interaksi elektron valensi
bisa bervariasi salah satunya adalah ikatan kovalen. Ikatan kovalen terjadi
saat dua buah atom berbagi elektron valensinya secara bersama-sama. Contohnya adalah
atom hidrogen. Atom hidrogen memiliki satu buah elektron valensi. Untuk memenuhi
kestabilan bilangan oktet (ingat bahwa kulit pertama akan stabil jika terpenuhi
dengan dua elektron) maka atom hidrogen membutuhkan satu elektron dari atom
hidrogen lain yang juga membutuhkan satu elektron agar kulit valensinya stabil.
Kedua atom hidrogen “sepakat” untuk saling mendekatkan elektron valensi mereka
sehingga menjadi berpasangan dan akhirnya akan dipakai mengorbit mengitari dua
atom hidrogen tadi. Hasil interaksi ini menjadi molekul H2.
Contoh lain adalah pada molekul oksigen (O2). Satu atom
oksigen memiliki nomor atom 16 yang artinya terdapat 16 proton dan 16 elektron.
Maka elektron akan terkonfigurasi dengan cara menempatkan dua elektron di kulit
pertama, delapan elektron di kulit kedua, dan enam elektron sisanya di kulit
ketiga. Perhatikan bahwa enam elektron di kulit ketiga inilah yang akan menjadi
elektron valensi oksigen. Untuk memenuhi bilangan oktet maka atom oksigen
membutuhkan dua elektron untuk dipakai bersama. Ketika berinteraksi dengan atom
oksigen lain maka masing masing akan menyumbangkan dua elektron bebasnya
membentuk ikatan kovalen ganda.
Sekarang kita akan melihat atom nitrogen yang memiliki
elektron valensi lima. Dimana dua buah atom sudah berpasangan dan menyisakan
tiga elektron bebas. Tiga elektron bebas ini dapat berikatan dengan tiga elektron
bebas dari atom nitrogen lain dan membentuk ikatan kovalen rangkap tiga.
Ikatan kovalen polar
dan non polar
Interaksi atom oksigen dengan hidrogen akan membutuhkan dua
atom hidrogen untuk menyumbangkan masing masing elektron valensinya kepada oksigen
dan terciptalah molekul H2O atau air (Molekul
adalah gabungan dua atom atau lebih yang diikat oleh ikatan kovalen). Saat atom
oksigen dan dua atom hidrogen membentuk ikatan kovalen maka keempat elektron
oksigen yang tidak berikatan dengan atom hidrogen berkumpul di daerah oksigen
dan menyebabkan daerah oksigen bermuatan parsial negatif. Sedangkan di daerah
hidrogen cenderung bermuatan parsial positif. Perbedaan muatan parsial dari dua
daerah inilah yang menciptakan kutub atau polaritas positif dan negatif di
molekul air. Ikatan kovalen polar dapat ditentukan dari kelektronegatifan salah
satu atom yang berikatan dan oksigen sangat elektronegatif.
Sekarang kita akan melihat atom karbon yang bervalensi
empat. Atom karbon membutuhkan empat elektron agar stabil. Kita ambil contoh
jika karbon berikatan dengan empat atom hidrogen yang masing masing
menyumbangkan satu elektron maka akan terbentuk molekul CH4 atau metana. Pada kasus
ini elektron-elektron yang berinteraksi akan terdistribusi secara merata baik
didaerah karbon maupun hidrogen. Distribusi yang merata ini tidak menyebabkan
adanya beda polaritas antara karbon dan hidrogen. Jenis ikatan kovalen pada
metana merupakan contoh dari ikatan kovalen nonpolar.
Ikatan Hidrogen
Ikatan kovalen polar mendorong daerah hidrogen yang
bermuatan positif untuk berikatan dengan oksigen yang bermuatan negatif dari
molekul air yang lainnya. Ikatan yang tercipta dari perbedaan muatan di satu
molekul air dengan molekul air lainnya disebut dengan ikatan hidrogen. Ikatan hidrogen pada molekul air memberikan banyak
keistimewaan pada air untuk mendukung kehidupan. Kita akan membahas air dan kehidupan
di pembahasan selanjutnya.
Polaritas pada ikatan kovalen polar bukanlah benar benar disebabkan
karena perbedaan jumlah proton dan elektron. Molekul air memiliki rasio proton
dan elektron yang tetap sehingga sebenarnya molekul ini bermuatan netral. Contoh
ikatan kimia yang bermuatan karena perbedaan jumlah proton dan elektron akan
kita temui di ikatan ionik.
Ikatan Ionik
Ikatan ionik terjadi ketika atom merebut elektron atom lain
atau membuang elektronnya sendiri untuk mencapai kestabilan bilangan oktet. Atom
yang membuang elektronnya akan menyebabkan dirinya kelebihan proton dan menjadi
ion positif atau kation. Sedangkan
atom yang merebut elektron dari atom
lain akan menyebabkan dirinya kelebihan elektron. Contoh dari ikatan ini dapat
kita temukan di ikatan antara natrium (Na) dan klorin (Cl) untuk membentuk
garam dapur atau NaCl.
Natrium (Na) bernomor atom 11 yang artinya terdapat 11
proton dan 11 elektron. Dua elektron mengisi kulit pertama, delapan aelektron
di kulit kedua dan satu elektron di kulit ketiga. Dari konfigurasi elektron
tersebut maka natrium memiliki elektron valensi satu. Untuk memenuhi bilangan
oktet maka atom natrium membutuhkan tujuh elektron. Sulit bagi natrium untuk
menarik tujuh elektron untuk mencapai bilangan oktet. Akan lebih mudah bagi
natrium untuk melepas satu elektron terluarnya dan menyisakan kulit keduanya
yang sudah stabil dengan delapan elektron yang stabil. Sedangkan atom klorin
bervalensi tujuh dan hanya membutuhkan satu elektron. Sangat mudah bagi klorin
untuk menarik satu elektron agar bilangan oktet terpenuhi.
Dari kondisi diatas, ketika natrium dan klorin berdekatan
maka natrium akan melepaskan satu elektronnya dan menyisakan 10 elektron. Hal
ini menyebabkan jumlah proton dan elektronnya tidak lagi sama (11 proton dan 10
elektron). Perbedaan muatan inilah yang menjadikan natrium bermuatan positif
(Na+) dan disebut dalam keadaan terionisasi. Perhatikan sebuah tanda
plus yang menandakan kelebihan satu proton.
Sedangkan klorin yang bernomor atom 17 memiliki 17 proton
dan 17 elektron. Ketika klorin berinteraksi dengan natrium maka elektron yang
dilepaskan oleh natrium akan segera bergabung dengan tujuh elektron valensinya
untuk mencapai bilangan oktet. Sebagai konsekuensinya kini klorin memiliki 18
elektron dan 17 proton. Jumlah rasio proton dan elektron yang tak lagi sama ini
menyebabkan klorin kelebihan elektron dan bermuatan negatif. Kini klorin dalam
keadaan terionisasi (Cl-) atau disebut anion. Tanda negatif pada lambang Cl menandakan ion klorin yang
kelebihan satu elektron.
Ikatan ionik ini juga sering disebut dengan ikatan garam. Klorin dapat membentuk ikatan ionik semacam ini dengan sebagian besar atom lain dari golongan I (alkali) dan II (logam alkali). Atom kalium (K) membentuk KCl, Magnesium (Mg) membentuk MgCl2 dan sebagainya.
Selanjutnya kita akan membahas tentang molekul yang sangat penting bagi kehidupan yaitu AIR. Bagaimana air bekerja, apa yang menyebabkan air begitu penting bagi kehidupan.
















Comments
Post a Comment